10/11/2025
Zhenlong Liu, M.D., Zhenchen Hou, M.D., Tong Pan, M.D., Weixin Ye, M.D.,
Chang Liu, M.D., Yingfang Ao, M.D., and Xi Gong, M.D.
Tóm tắt:
Điều trị tổn thương sụn là một chủ đề được quan tâm rộng rãi trên toàn thế giới. Gần đây, kỹ thuật mô sinh học đã được ứng dụng trong phục hồi tổn thương sụn. Tại Trung Quốc, một số loại scaffold (giá đỡ sinh học) đã được phê duyệt để thử nghiệm lâm sàng với mục tiêu phục hồi sụn. Việc cấy ghép thành công scaffold vào vùng khuyết sụn là yếu tố then chốt cho hiệu quả điều trị. Kỹ thuật thực hiện đóng vai trò thiết yếu trong việc đảm bảo scaffold được cấy chính xác, từ đó ảnh hưởng trực tiếp đến tiên lượng điều trị. Các báo cáo quốc tế về công nghệ cấy ghép scaffold mô sinh học đã chỉ ra cả ưu điểm và hạn chế. Tuy nhiên, do giới hạn về thiết bị và vật liệu, một số kỹ thuật phẫu thuật đang được sử dụng ở nước ngoài hiện chưa thể áp dụng tại Trung Quốc. Nhằm tối ưu hóa công nghệ scaffold mô sinh học trong điều trị tổn thương sụn tại Trung Quốc, bài viết kỹ thuật này tập trung thảo luận về các kỹ năng và quy trình cấy ghép, đặc biệt là phương pháp cấy ghép qua đường rạch nhỏ sử dụng scaffold từ xương vỏ–xốp đã khử khoáng. Nghiên cứu này góp phần vào việc chuẩn hóa quy trình phẫu thuật sử dụng công nghệ scaffold mô sinh học trong phục hồi tổn thương sụn.
Sụn khớp là một cấu trúc thiết yếu của khớp gối. Nó có bề mặt trơn láng và đàn hồi, giúp giảm ma sát giữa các xương và hấp thụ lực tác động, đóng vai trò quan trọng trong việc duy trì chức năng khớp¹. Do có ma trận ngoại bào dày đặc và không có mô mạch máu, sụn khớp hầu như không được cấp máu. Vì vậy, sụn chỉ nhận được dưỡng chất từ dịch khớp, điều này khiến quá trình tái tạo và phục hồi sau chấn thương trở nên khó khăn². Các tổn thương như vậy có thể dẫn đến thoái hóa khớp, gây suy giảm chức năng, thậm chí mất chức năng vận động³ ⁴.
Các phương pháp điều trị tổn thương sụn khớp bao gồm làm sạch khớp, khoan vi lỗ và cấy ghép tế bào sụn tự thân⁵⁻⁸. Mỗi phương pháp đều có những ưu điểm và hạn chế riêng. Làm sạch khớp và khoan vi lỗ có thể giúp giảm triệu chứng và tương đối dễ thực hiện. Tuy nhiên, các phương pháp này không tạo ra sụn hyaline tại vị trí tổn thương và hiệu quả lâu dài còn hạn chế. Cấy ghép sụn tự thân có nguy cơ gây tổn thương tại vị trí cho mô, trong khi cấy ghép đồng loại lại gặp khó khăn về nguồn cung. Hiện nay, khoan vi lỗ vẫn là kỹ thuật chính trong điều trị tổn thương sụn. Tuy nhiên, một thách thức lớn là sụn tái tạo chủ yếu là sụn sợi (fibrocartilage), không có đầy đủ đặc tính cơ học sinh học của sụn hyaline.
Trong những năm gần đây, công nghệ sinh sụn cảm ứng trên nền tự thân (autologous matrix-induced chondrogenesis – AMIC) đã có những bước tiến đáng kể¹ ⁹⁻¹¹ và được chứng minh là mang lại cải thiện rõ rệt ở các bệnh nhân có tổn thương sụn lớn có triệu chứng¹². Kỹ thuật AMIC bao gồm việc đặt một lớp vật liệu sinh học bao phủ sau khi thực hiện khoan vi lỗ. Phương pháp này giúp cung cấp độ bền ban đầu và bảo vệ cơ học cho cục máu đông chứa các tế bào gốc trung mô từ tủy xương¹³, đồng thời đóng vai trò như một khung 3 chiều để tế bào gốc bám vào, tăng sinh và biệt hóa. Kỹ thuật này giúp cải thiện đặc tính cơ học của sụn tái tạo, khiến nó gần giống với sụn hyaline hơn¹⁴. Các ưu điểm của kỹ thuật AMIC bao gồm khả năng kết hợp với khoan vi lỗ để hoàn tất việc sửa chữa chỉ trong một lần phẫu thuật, và tránh phải lấy mô tự thân khỏe mạnh từ bệnh nhân, từ đó ngăn ngừa tổn thương thứ phát tại vị trí cho mô. Tác dụng cơ học và khả năng cảm ứng biệt hóa của scaffold giúp tạo ra mô sụn tái tạo vượt trội so với sụn sợi và gần giống sụn hyaline hơn¹⁵. Bài viết kỹ thuật này sẽ trình bày chi tiết các thao tác phẫu thuật cho phương pháp nội soi và cấy ghép qua đường rạch nhỏ sử dụng scaffold từ xương vỏ–xốp đã khử khoáng trong điều trị tổn thương sụn.
Kỹ thuật phẫu thuật
Qua quá trình nghiên cứu và sàng lọc, chúng tôi nhận thấy rằng các đặc tính cơ học của xương vỏ–xốp đã khử khoáng gần giống với sụn. Loại scaffold này có nhiều ưu thế vượt trội so với vật liệu tổng hợp về cả hình thái học lẫn tính chất cơ học. Thứ nhất, nó có mô-đun đàn hồi và khả năng chịu nén tương đương với mô sụn. Scaffold chủ yếu được cấu tạo từ collagen tự nhiên loại I, là nền lý tưởng cho sự bám dính và phát triển của tế bào. Thứ hai, scaffold có khả năng phân hủy sinh học và có thể được cơ thể hấp thụ một cách dễ dàng như một vật liệu sinh học. Ngoài ra, nó còn có cấu trúc xốp tự nhiên giúp thúc đẩy sự xâm nhập của tế bào và tương tác với các cytokine cũng như các chất hoạt tính sinh học. Thành phần xương xốp cung cấp cấu trúc ba chiều dạng xốp hỗ trợ tế bào phát triển, trong khi phần xương vỏ cung cấp độ bền cơ học cần thiết¹⁶ ¹⁷.
Chuẩn bị
Chỉ định và đánh giá bệnh nhân
Kỹ thuật này phù hợp với những bệnh nhân có tổn thương sụn khớp gối có kích thước từ 1 đến 8 cm², kèm theo triệu chứng đau hoặc giảm chức năng gối ảnh hưởng đến sinh hoạt hàng ngày hoặc hoạt động thể thao. Độ tuổi khuyến nghị cho bệnh nhân là từ 18 đến 55 tuổi. Các tiêu chuẩn loại trừ bao gồm: có bệnh viêm khớp dạng thấp, thoái hóa khớp nặng, hoặc lệch trục khớp đáng kể.
Lập kế hoạch trước phẫu thuật
Chụp cộng hưởng từ (MRI) trước phẫu thuật là cần thiết để đánh giá mức độ tổn thương sụn và xương dưới sụn. Cần đảm bảo bệnh nhân không có bằng chứng của viêm khớp dạng thấp, thoái hóa khớp nặng hoặc lệch trục khớp rõ rệt. Phương pháp gây tê được sử dụng là gây tê tủy sống.
Các vật liệu và thiết bị cần thiết bao gồm:
– Scaffold xương vỏ–xốp đã khử khoáng (sản xuất bởi Bệnh viện số 3 Đại học Bắc Kinh, Bắc Kinh, Trung Quốc)
– Đinh cố định sụn (Biofix; Bioscience Ltd., Tampere, Phần Lan)
– Dụng cụ định vị scaffold xương vỏ–xốp đã khử khoáng (sản xuất bởi Bệnh viện số 3 Đại học Bắc Kinh)
– Dụng cụ khoan vi lỗ, dao cạo, dụng cụ bào, mũi khoan mài
– Thiết bị nội soi khớp
Quy trình phẫu thuật
Nội soi khớp và chuẩn bị scaffold
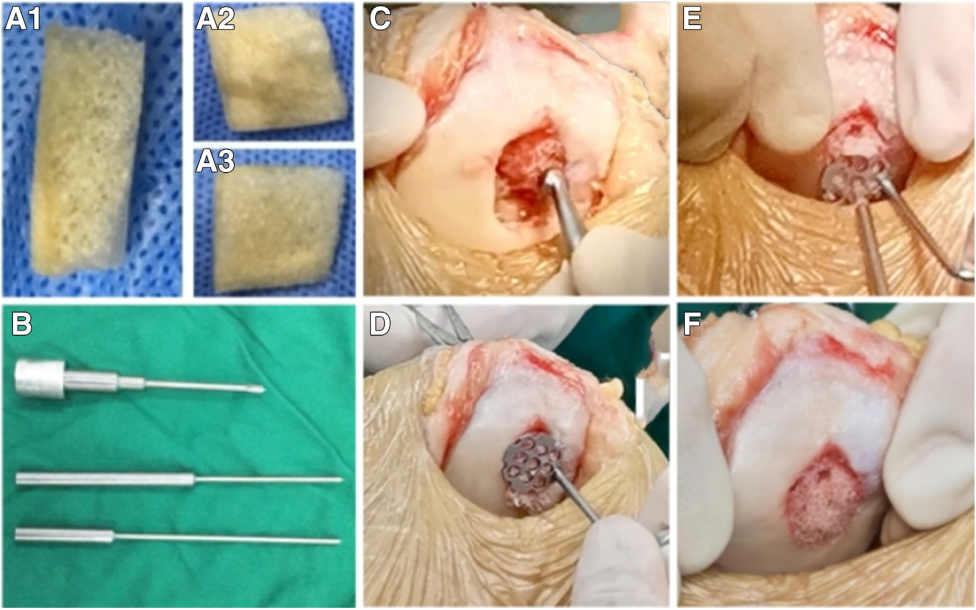
Sau khi gây tê, tiến hành khoan vi lỗ sau bước làm sạch vùng tổn thương sụn bằng nội soi thông qua cổng tiếp cận thông thường. Thiết lập hai cổng nội soi: cổng trước–trong (cổng thao tác) và cổng trước–ngoài (cổng quan sát) vào khớp gối. Dưới nội soi, thăm dò và đánh giá vùng tổn thương. Dùng dao bào (planer) để làm sạch vùng sụn tổn thương. Sau đó, dùng dụng cụ nạo (scraper) để loại bỏ phần sụn không ổn định ở rìa tổn thương. Sử dụng thiết bị khoan vi lỗ để tạo các vi lỗ ở bề mặt tổn thương. Trong các trường hợp đặc biệt như có hiện tượng tăng sản xương (hyperosteogeny), dùng mũi khoan mài để loại bỏ phần xương dư thừa nhằm tạo bề mặt nhẵn cho việc đặt scaffold.
Rút ống nội soi ra và bộc lộ vị trí tổn thương thông qua một đường rạch nhỏ. Dựa vào kích thước và vị trí của tổn thương, tạo một đường rạch tối thiểu khoảng 3 cm gần vùng khuyết. Tiến hành rạch lần lượt qua da và mô dưới da. Sau đó, tiếp tục làm sạch phần sụn tổn thương bằng dụng cụ nạo để làm ổn định mép tổn thương. Khi đã rạch xong, tiến hành đo chính xác kích thước và hình dạng của vùng tổn thương dưới tầm nhìn trực tiếp.
Chọn và cắt tỉa scaffold xương đã khử khoáng dưới tầm nhìn trực tiếp. Lựa chọn scaffold xương vỏ–xốp đã khử khoáng có kích thước phù hợp và làm ẩm bằng dung dịch nước muối sinh lý. Cắt tỉa scaffold dựa trên kích thước đã đo, bắt đầu bằng phần xương vỏ, sau đó điều chỉnh phần xương xốp để phù hợp với độ sâu của vùng khuyết sụn. Tránh thao tác lặp lại quá nhiều ở vùng tiếp giáp giữa các lớp của scaffold trong quá trình cắt tỉa, vì điều này có thể gây nứt gãy và làm giảm độ bền của scaffold.
Quy trình cấy ghép scaffold xương vỏ–xốp đã khử khoáng qua đường rạch nhỏ
Đặt scaffold vào trong khớp, đảm bảo rằng mặt xương vỏ được hướng về phía xương dưới sụn. Cố định scaffold xương đã khử khoáng tại vùng khuyết bằng dụng cụ định vị dạng tổ ong do nhóm nghiên cứu phát triển. Thông qua các kênh dẫn trên bề mặt dụng cụ định vị, sử dụng mũi khoan 1,5 mm để khoan xuyên qua phần xương xốp và xương vỏ, tạo đường hầm xương sâu từ 15 đến 20 mm. Dựa vào độ sâu và vị trí của đường hầm, chọn đinh cố định sụn có kích thước phù hợp để cấy ghép. Thông thường, đinh sụn kích thước 1,5 mm × 15 mm hoặc 1,5 mm × 20 mm được sử dụng để cố định scaffold. Tùy theo kích thước vùng tổn thương, cấy từ 2 đến 4 đinh sụn để đảm bảo sự ổn định của scaffold. Khi đóng đinh sụn, lực gõ phải nhẹ nhàng, tránh dùng lực mạnh vì có thể làm đinh xuyên qua khung xương vỏ, dẫn đến thất bại trong cố định.
Sau khi cố định scaffold vào đúng vị trí, dùng dao bào để chỉnh lại bề mặt scaffold, đảm bảo phẳng đều với vùng khuyết sụn. Gập và duỗi khớp gối lặp lại từ 10 đến 20 lần để kiểm tra độ ổn định của việc cố định (Hình 1). Kết thúc phẫu thuật sau khi rửa sạch hoàn toàn vùng mổ, sau đó cố định khớp gối ở tư thế duỗi bằng băng ép và nẹp hỗ trợ.


Thảo luận
Tổn thương sụn là tình trạng phổ biến trong thực hành lâm sàng, thường do chấn thương thể thao, gãy xương hoặc quá trình lão hóa, dẫn đến thay đổi về cấu trúc và chức năng¹⁸. Các phương pháp điều trị thông dụng hiện nay đều có những hạn chế nhất định. Kỹ thuật khoan vi lỗ chỉ tạo ra sụn sợi (fibrocartilage), vốn có tiên lượng lâu dài kém. Cấy ghép sụn–xương đồng loại gặp khó khăn do yêu cầu cao về nguồn hiến tặng và tình trạng thiếu hụt mô ghép. Cấy ghép tế bào sụn tự thân có thể gây tổn thương thứ phát do phải lấy mô từ chính bệnh nhân. Sụn khớp nhân tạo bằng kỹ thuật mô sinh học vẫn còn cần cải tiến. Phần lớn các ca phẫu thuật scaffold mô sinh học trước đây đòi hỏi khâu cố định, làm kéo dài thời gian mổ và ảnh hưởng đáng kể đến quá trình phục hồi của bệnh nhân.
Kỹ thuật phẫu thuật do nhóm tác giả phát triển mang lại những lợi thế đặc biệt. Thứ nhất, chúng tôi sử dụng scaffold xương vỏ–xốp đã khử khoáng có quyền sở hữu trí tuệ độc lập, thể hiện các đặc tính cơ học và sinh học vượt trội. Lớp đỡ của scaffold đảm bảo độ bền cơ học, trong khi lớp chức năng có khả năng giữ tế bào gốc cao, giúp thu nhận nhiều tế bào gốc từ tủy xương hơn. Thiết kế này thúc đẩy quá trình tăng sinh và biệt hóa của tế bào gốc, từ đó giúp phục hồi tổn thương sụn một cách hiệu quả. Thứ hai, kỹ thuật phẫu thuật này có phạm vi ứng dụng rộng hơn. Các scaffold thường dùng trong lâm sàng hiện nay bị hạn chế trong các trường hợp có khuyết hổng lớn ở xương dưới sụn (>3 mm) do chúng chỉ có cấu trúc hai chiều. Trong khi đó, scaffold của chúng tôi có cấu trúc ba chiều, thích hợp hơn với các tổn thương dạng này. Ngoài ra, so với phương pháp khâu cố định truyền thống, kỹ thuật của chúng tôi sử dụng đinh sinh học tự tiêu để cấy ghép scaffold¹⁹, giúp quy trình đơn giản hơn và tạo sự cố định chắc chắn hơn cho scaffold.
Mặc dù có nhiều ưu điểm, công nghệ này vẫn tồn tại một số hạn chế. Scaffold cần được điều chỉnh bằng tay để khớp chính xác với hình dạng vùng tổn thương sụn, do đó đòi hỏi sự phù hợp hình thái rất cao. Việc đo đạc chính xác là yếu tố then chốt để đảm bảo cấy ghép hiệu quả. Bên cạnh đó, kỹ thuật phẫu thuật hiện tại vẫn cần một đường rạch nhỏ, điều này vẫn mang tính xâm lấn nhất định đối với bệnh nhân. Xét trong bối cảnh công nghệ hiện tại, các hướng phát triển trong tương lai nên tập trung vào việc hoàn tất toàn bộ quy trình dưới nội soi, nhằm mang lại lợi ích cho nhiều bệnh nhân hơn. Bảng 1 liệt kê các ưu điểm/kinh nghiệm (pearls) và nhược điểm/lưu ý sai sót (pitfalls), bao gồm các rủi ro và giới hạn của kỹ thuật phẫu thuật này.
Tài liệu tham khảo
1. Gao L, Orth P, Cucchiarini M, Madry H. Autologous matrix-induced chondrogenesis: A systematic review of
the clinical evidence. Am J Sports Med 2019;47:222-231.
2. Elias TJ, Morgan V, Chan J, Gomoll AH, Yanke AB. Cell transplantation techniques for cartilage restoration.
J Cartilage Joint Preserv 2023;3:100103.
3. Steinwachs MR, Gille J, Volz M, et al. Systematic review and meta-analysis of the clinical evidence on the use of
autologous matrix-induced chondrogenesis in the knee. Cartilage 2021;13:42s-56s.
4. Strickland CD, Ho CK, Merkle AN, Vidal AF. MR imaging of knee cartilage injury and repair surgeries. Magn Reson
Imaging Clin N Am 2022;30:227-239.
5. Redondo ML, Beer AJ, Yanke AB. Cartilage restoration: Microfracture and osteochondral autograft transplantation. J Knee Surg 2018;31:231-238.
6. Müller PE, Gallik D, Hammerschmid F, et al. Third-generation autologous chondrocyte implantation after failed bone marrow stimulation leads to inferior clinical results. Knee Surg Sports Traumatol Arthrosc 2020;28:470-477.
7. Thomas V, Mercuri J. In vitro and in vivo efficacy of naturally derived scaffolds for cartilage repair and regeneration. Acta Biomater 2023;171:1-18.
8. Kaiser JT, Hevesi M, Wagner KR, Meeker ZD, Cole BJ. Augmented marrow stimulation: Drilling techniques and
scaffold options: “Next generation cartilage repair and the pre-arthroplasty patient y derived scaffolds for cartilage
repair. Op Tech Sports Med 2022;30:150958.
9. Kim JH, Heo JW, Lee DH. Clinical and radiological outcomes after autologous matrix-induced chondrogenesis versus microfracture of the knee: A systematic review and meta-analysis with a minimum 2-year follow-up. Orthop J Sports Med 2020;8:2325967120959280.
10. Tan CHB, Huang XO, Tay ZQ, Bin Abd Razak HR. Arthroscopic and open approaches for autologous matrixinduced chondrogenesis repair of the knee have similar results: A meta-analysis. J ISAKOS 2024;9:192-204.
11. Migliorini F, Eschweiler J, Götze C, Driessen A, Tingart M, Maffulli N. Matrix-induced autologous chondrocyte mplantation (mACI) versus autologous matrix-induced chondrogenesis (AMIC) for chondral defects of the knee: A systematic review. Br Med Bull 2022;141:47-59.
12. Grossman AD, Den Haese JP Jr, Georger L, Mc Millan S, Tuck JA. Matrix-induced autologous chondrocyte implantation (MACI) is largely effective and provides significant improvement in patients with symptomatic, large chondral defects: A systematic review and meta-analysis. Surg Technol Int 2022;41:329-335.
13. Weigelt L, Hartmann R, Pfirrmann C, Espinosa N, Wirth SH. Autologous matrix-induced chondrogenesis for osteochondral lesions of the talus: A clinical and radiological 2- to 8- year follow-up study. Am J Sports Med 2019;47:1679-1686.
14. Fossum V, Hansen AK, Wilsgaard T, Knutsen G. Collagencovered autologous chondrocyte implantation versusautologous matrix-induced chondrogenesis: A randomized trial comparing 2 methods for repair of cartilage defects of the knee. Orthop J Sports Med 2019;7:2325967119868212.
15. Peñalver JM, Villalba J, Yela-Verdú CP, Sánchez J, Balaguer-Castro M. All-arthroscopic nanofractured autologous matrix-induced chondrogenesis (A-NAMIC) technique for the treatment of focal chondral lesions of the knee. ArthroscTech 2020;9:e755-e759.
16. Huang H, Zhang X, Hu X, et al. A functional biphasic biomaterial homing mesenchymal stem cells for in vivo cartilage regeneration. Biomaterials 2014;35:9608-9619.
17. Zhang X, Zheng Z, Liu P, et al. The synergistic effects of microfracture, perforated decalcified cortical bone matrix and adenovirus-bone morphogenetic protein-4 in cartilage defect repair. Biomaterials 2008;29:4616-4629.
18. Li M, Yin H, Yan Z, et al. The immune microenvironment in cartilage injury and repair. Acta Biomater 2022;140: 23-42.
19. Liu Z, Ye F, Ao Y, Gong X. Absorbable nail fixation of biologic membrane for treatment of cartilage defects by matrix-induced autologous chondrocyte implantation. Arthrosc Tech 2024:102984.
© 2023 The Heat